#PMBAgrobacterium
Agrobacterium tumefaciens es una bacteria que se caracteriza y se aísla como patógena de plantas en 1897 a partir de las agallas de la vid. En otras palabras, lo que hace esta bacteria es provocar tumores en las plantas. Voy a intentar explicar este proceso bioquímico en el que la bacteria Agrobacterium tumefaciens provoca tumores en las plantas, y como el descifrar este mecanismo, ha servido como herramienta de edición genética en plantas. Creando así, las conocidas como plantas genéricamente modificadas o plantas transgénicas (1).
Agrobacterium tumefaciens es una bacteria que se caracteriza y se aísla como patógena de plantas en 1897 a partir de las agallas de la vid. En otras palabras, lo que hace esta bacteria es provocar tumores en las plantas. Voy a intentar explicar este proceso bioquímico en el que la bacteria Agrobacterium tumefaciens provoca tumores en las plantas, y como el descifrar este mecanismo, ha servido como herramienta de edición genética en plantas. Creando así, las conocidas como plantas genéricamente modificadas o plantas transgénicas (1).
Para ello, tengo que explicar un par de cosas previas como ¿Que es un plásmido? Recordamos la estructura básica de una bacteria, donde tenemos, de fuera adentro: Pared celular, membrana plasmática, el citoplasma (líquido del interior celular entre las diferentes estructuras), ADN (generalmente circular, para todo hay excepciones), ribosomas y en ocasiones plásmidos.
 |
| Fig. 1: Estructura de una bacteria. Imagen encontrada en www.paradais-sphynx.com |
Los plásmidos, son estructuras genéticas circulares que portan información, generalmente valiosa para la bacteria, pero no esencial en principio para su vida, me explico. La información necesaria para realizar todos los procesos metabólicos que permiten la vida de la bacteria, están codificados en el ADN circular (genoma de la bacteria). En ocasiones, el ambiente se vuelve hostil o aparecen unas condiciones diferentes para vivir, de tal forma que un plásmido, puede portar información que favorece la supervivencia en ese entorno. Es lo que sucede en la mayoría de las resistencias a antibióticos, donde una bacteria sensible a un antibiótico capta de otra bacteria resistente por diversos mecanismos un plásmido de resistencia a ese antibiótico, y que le facilitaría la vida en este entorno (figura 1). A este agente que discrimina la supervivencia de las células o bacterias se le llama agente selector.
Como se observa en la figura 2, la bacteria al dividirse tiene que duplicar su material genético (material genómico y plásmido). Sin embargo, por mero azar, en ocasiones las células no reparten bien su material genómico, de tal forma que, una se queda con las copias plasmídicas de las células y la otra no recibe ningún plásmido.
Generalmente, cuando el agente selector desaparece y la bacteria deja de estar expuesta a los elementos que seleccionan el plasmado, este se pierde ¿Por qué sucede esto? Digamos que, metabólicamente, es desfavorable mantener un plasmado si no ofrece beneficio, ya que al mantener el plásmido, se gasta energía que la bacteria no invierte en crecer. Esta situación es la que pretendo reflejar en la figura 3. Existen algunas publicaciones que estiman la pérdida por otros mecanismos de los plásmidos como Sengupta & Austin (2011).
Después de este paréntesis, que debe ayudar a comprender el peligro del uso indiscriminado de antibióticos, y la función que cumplen los plásmidos, continuamos explicando lo que sucede con Agrobacterium tumefaciens y su plásmido Ti.
A través de un mecanismo de transferencia de material genética, la bacteria, tiene la capacidad de transmitir a varias especies de plantas parte de una secuencia génica conferida en el denominado plásmido Ti. Esta secuencia que la bacteria es capaz de transmitir al interior de la célula vegetal es el denominado ADN-T. La secuencia se inserta en el genoma de la célula vegetal y, es responsable de activar un aumento de hormonas vegetales (auxinas y citoquinina), que son la causa de generar tumores en la planta (1).
Como es evidente, solo son patógenas para las plantas aquellas cepas de A. tumefaciens que tienen el plásmido Ti ¿Por qué A. tumefaciens causa tumores en las plantas? Ningún organismo hace las cosas porque si, podemos conocer o no las razones, pero siempre hay un porqué. En el caso de Agrobacterium, infecta a la planta provocando la generación de tumores, para que el tumor (la planta) secrete una sustancia denominada opina (opines en inglés), y que sirve de alimento solo a Agrobacterium (2, 3). Si nos fijamos en la figura 4, podemos ver como el T-ADN que se va a transferir a la célula vegetal tiene los genes para aumentar las hormonas (auxinas y citoquinas) que darán lugar al tumor y los genes para sintetizar las opinas, que servirán de alimento a Agrobacterium. Esto es porque las opinas no pueden ser degradadas por la célula vegetal y, el plásmido Ti tiene la secuencia que codifica las enzimas que degradan estas opinas, en ningún caso esta enzima degradadora de opians pasan a la célula vegetal, por no formar parte de la región T-ADN.
Una vez esta célula tiene insertado en su genoma el T-ADN, pasa a convertirse en una célula transformada. La célula comienza a expresar sus nuevos genes que provocan un aumento de las hormonas vegetales auxinas y citoquininas para la desdiferenciación celular, provocando un crecimiento y división celular descontrolado formando tumores. Los tumores tienen una enzima que se denomina Opina Sintasa (OS). La OS utiliza como sustrato piruvato y diversos aminoácidos para sintetizar unas sustancias denominadas opinas (5). Las opinas no pueden ser degradadas por las células vegetales, pero la maquinaria que A. tumefaciens, transporta a la célula vegetal están factores de transporte de Opinas para inyectarlas al interior de Agrobacterium. Las opinas en el interior de Agrobacterium son catabolizadas (degradadas) por la enzima Opina catalasa. Esto genera energía en la célula sirviendo de alimento a Agrobacterium. Sin quererlo, la célula vegetal se a convertido en la esclava de la bacteria para generar alimento. Ver todo el proceso descrito en la figura 5, pero es un esquema simplificado, la realidad es mucho más compleja.
Las plantas Bt son plantas transgénicas que se les a introducido el gen Cry (de Crystal en inglés) de Bacillus thuringiensis (Bt). Esta proteína, cuando es ingerida por los insectos causa la muerte. Por tanto, las plantas que portan este gen, expresan la proteína Cry en sus tejidos y son un insecticida natural contra los insectos (6). Se puede decir que las plantas Bt son plantas tóxicas para los insectos y evitar usar plaguicidas siendo ellas mismas el control de las plagas en vez de las sustancias químicas.
Se han realizado muchas plantas Bt para prevenir plagas de lepidópteros principalmente. Aunque también hay proteínas Cry que afectan a otros insectos como dípteros o coleópteros. También hay que destacar, que ningún método es infalible, y los insectos también acaban desarrollando resistencias a la proteína Cry. Las plantas más conocidas son el algodón Bt y el maíz Bt (6).
El mecanismo de acción de la proteína Cry se explica aquí:
¿Como se hace esto?
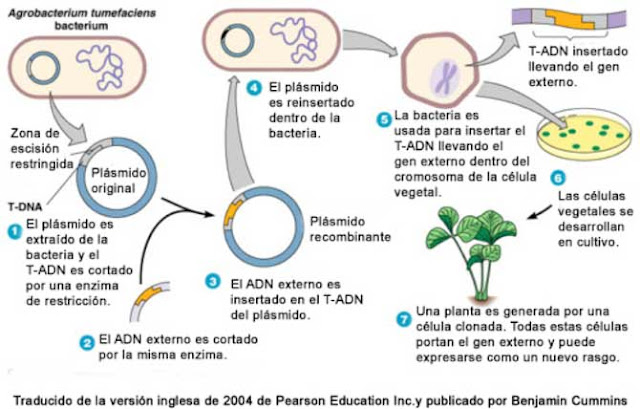
Mediante técnicas de ingeniería genética, se puede modificar el plásmido Ti y dejar los mecanismos que nos interesa, eliminar la región oncogénica del T-DNA y sustituirla por un gen que queremos insertar en la célula vegetal. Las herramientas que se suelen emplear en este trabajo son las conocidas enzimas de restricción, unas proteínas que son capaces de cortar unas secuencias específicas en el genoma y se pegan los extremos utilizando otra enzima denominada polimerasa. Así conseguimos un plásmido que nos servirá de vector genético, para insertar un o varios genes en la planta. Si quiere saber un poco más vaya al apartado: Aclaraciones moleculares de la edición de secuencias de ADN.
¿Qué pasos se siguen?
Primero, este plásmido se introduce en el interior de Agrobacterium mediante diferentes técnicas y se seleccionan las cepas transformadas que tienen en el interior el plásmido que deseamos. Después, se enfrenta a la bacteria con la parte de la planta que queremos transformar. Hay que decir, que la bacteria solo transforma una serie de células que se exponen a la bacteria, por lo que si quieres tener generaciones de plantas que porten este nuevo gen hay que combinar varias técnicas.
El método que se suele emplear en plantas, es infectar una parte de la planta (parte de una hoja, tallo o raíz). Estas partes se infectan con Agrobacterium y después se cultivan in vitro. Esto es gracias a una propiedad que tienen las plantas y que no tiene ningún animal, que es la totipotencia. Cualquier célula vegetal puede desarrollar cualquier tejido de la planta y por ello se puede obtener una planta completa (7,8). Mediante diversos tratamientos con hormonas vegetales, se generan los diferentes tejidos. Se necesita conocer la combinación de hormonas para generar las diferentes partes de la planta, ya que no todas las plantas responden a los mismos estímulos hormonales. Este es el método de transformación que se representa en la figura 6.
Hay que decir, que aunque se use una bacteria que en la naturaleza genera tumores en la planta. Las cepas de Agrobacterium que se usan en ingeniería genética, en ningún caso generan tumores, porque esos genes tumorales han sido eliminados.
Las células animales no son totipotentes salvo en los primeros estadios del desarrollo embrionario. Después, solo tenemos células pluripotentes que tienen capacidad de generar solo un número determinado de tejidos. Ya lo explicare en otras publicaciones.
Debo aclarar ante posibles dudas, que la tumoración que genera Agrobacterium es a causa de un desajuste en las hormonas vegetales auxinas y citoquinina (por si no ha quedado claro a lo largo de la explicación). Nosotros que pertenecemos al reino animal, no tenemos estas hormonas, ni la ingestión de estas hormonas nos afecta, ya que nuestras células no tienen receptores para estas hormonas. Esto es una tecnología moderna, que nos ayuda a solucionar graves problemas en la agricultura, generando plantas más resistentes a sequías, temperaturas extremas, plagas como las plantas Bt o resolver deficiencias nutricionales en los humanos como el Arroz dorado, al que se le introdujo el gen de la vitamina A para prevenir la ceguera en el tercer mundo.
Hay un miedo enorme a los transgénicos, asociado a que si consumimos estos alimentos, vamos a generar cáncer u otras enfermedades. Este miedo es una de esos rumores conspiratorios sin fundamento, que utilizan medias verdades para generar miedo en la población. Sin duda, es una tecnología que hay que tratar con precaución porque puede generar problemas ecológicos y que trataré en publicaciones posteriores. Pero, adelanto al público, que los alimentos que se comercializan como transgénicos, han sido evaluados por multitud de pruebas a través de la EFSA y son completamente SEGUROS.
Agrobacterium no es capaz de infectar todo tipo de plantas, por ello, existen otros mecanismos de transgénesis que iré explicando en futuras publicaciones.
La enzima de restricción EcoRI (obtenida de Escherichia coli) reconoce la secuencia naranja
5´-ACCGTTGAATTCTAGCTGATCGA-3´
3´-TGGCAACTTAAGATCGACTAGCT-5´
Resultado de la reacción produce el siguiente corte:
5´-ACCGTTG-3´ 5´-AATTCTAGCTGATCGA-3´
3´-TGGCAACTTAA -5´ 3´-GATCGACTAGCT-5´
Como es evidente, solo son patógenas para las plantas aquellas cepas de A. tumefaciens que tienen el plásmido Ti ¿Por qué A. tumefaciens causa tumores en las plantas? Ningún organismo hace las cosas porque si, podemos conocer o no las razones, pero siempre hay un porqué. En el caso de Agrobacterium, infecta a la planta provocando la generación de tumores, para que el tumor (la planta) secrete una sustancia denominada opina (opines en inglés), y que sirve de alimento solo a Agrobacterium (2, 3). Si nos fijamos en la figura 4, podemos ver como el T-ADN que se va a transferir a la célula vegetal tiene los genes para aumentar las hormonas (auxinas y citoquinas) que darán lugar al tumor y los genes para sintetizar las opinas, que servirán de alimento a Agrobacterium. Esto es porque las opinas no pueden ser degradadas por la célula vegetal y, el plásmido Ti tiene la secuencia que codifica las enzimas que degradan estas opinas, en ningún caso esta enzima degradadora de opians pasan a la célula vegetal, por no formar parte de la región T-ADN.
 |
| Fig. 4: Esquema de las secuencias encontradas en el plásmido Ti de A. tumefaciens. Como todo plásmido, tiene un Origen de Replicación (ORI) para hacer copias del plásmido. Además, tiene genes para la síntesis de auxinas, citoquininas y opina flanqueadas por dos secuencias (border) que conformarían el T-ADN (secuencia que se envía a la célula vegetal). En la célula vegetal se mantienen los factores de virulencia (genes para transferir el plásmido e inhibir las defensas moleculares de la célula vegetal), el ORI y los genes para degradar las opinas y obtener energía. Fuente de la imagen Wikipedia |
¿Como se realiza esta infección en la célula vegetal por la bacteria A. tumefaciens?
Aunque el proceso es muy complejo e intervienen muchos genes y proteínas en el proceso, vamos a destacar las más importantes para hacerlo comprensible. Agrobacterium es una bacteria que vive en el suelo, cuando esta bacteria tiene el plásmido Ti, sintetiza ciertas proteínas como VirA y VirG. Estas proteínas son un receptor enzimático (VirA) unido a la proteína G (VirG) que activará los factores de virulencia codificados en el plásmido Ti (1). Cuando una célula vegetal sufre daño celular, emite sustancias (fenoles, azúcares y pH) que son captadas por variantes del receptor VirA, informando del daño celular. VirA activa las proteínas de virulencia VirD2, VirE2, VirF y factores para el sistema de secreción tipo IV entre otros. Este sistema de secreción, construye un canal proteico a modo de aguja que inyectará los factores de virulencia y el T-ADN desde la bacteria a la célula vegetal. La activación del mecanismo Vir produce copias de T-ADN, al que se le unen los factores VirD2 y VirE2 para protegerlo (complejo T) y llevarlo al interior de la célula vegetal. Una vez allí, se une a la proteína vegetal VIP1 e introduce el complejo T en el núcleo vegetal a través de unos poros proteicos denominados Complejo del Poro Nuclear (CPN). En el núcleo vegetal, activan la maquinaria de reparación del ADN de la célula vegetal para engañarla, e insertar la secuencia de T-ADN de Agrobacterium en el genoma de la planta. Entonces comienza a expresar los genes del T-ADN y aumentan los niveles de las hormonas auxinas y citoquinina, desajustando el metabolismo y la expresión génica de la célula, para acabar generando tumores (células que crecen y se reproducen descontroladamente). La proteína VirF debe actuar más tarde para degradar las proteínas Vir y VIP1 en el interior del núcleo. VIP1 activa mecanismos de defensa contra patógenos, pero es necesaria para el proceso de transformación celular, por eso tiene que actuar en el momento apropiado (4,5).Una vez esta célula tiene insertado en su genoma el T-ADN, pasa a convertirse en una célula transformada. La célula comienza a expresar sus nuevos genes que provocan un aumento de las hormonas vegetales auxinas y citoquininas para la desdiferenciación celular, provocando un crecimiento y división celular descontrolado formando tumores. Los tumores tienen una enzima que se denomina Opina Sintasa (OS). La OS utiliza como sustrato piruvato y diversos aminoácidos para sintetizar unas sustancias denominadas opinas (5). Las opinas no pueden ser degradadas por las células vegetales, pero la maquinaria que A. tumefaciens, transporta a la célula vegetal están factores de transporte de Opinas para inyectarlas al interior de Agrobacterium. Las opinas en el interior de Agrobacterium son catabolizadas (degradadas) por la enzima Opina catalasa. Esto genera energía en la célula sirviendo de alimento a Agrobacterium. Sin quererlo, la célula vegetal se a convertido en la esclava de la bacteria para generar alimento. Ver todo el proceso descrito en la figura 5, pero es un esquema simplificado, la realidad es mucho más compleja.
¿Como se hacen las plantas transgénicas a través de este mecanismo?
Los investigadores se dieron cuenta que esta tecnología natural que ofrece la bacteria del género Agrobacterium, podía ser utilizada en nuestro beneficio. Modificando el plásmido Ti podríamos introducir genes en las plantas. El ejemplo más evidente son las conocidas plantas Bt.Las plantas Bt son plantas transgénicas que se les a introducido el gen Cry (de Crystal en inglés) de Bacillus thuringiensis (Bt). Esta proteína, cuando es ingerida por los insectos causa la muerte. Por tanto, las plantas que portan este gen, expresan la proteína Cry en sus tejidos y son un insecticida natural contra los insectos (6). Se puede decir que las plantas Bt son plantas tóxicas para los insectos y evitar usar plaguicidas siendo ellas mismas el control de las plagas en vez de las sustancias químicas.
Se han realizado muchas plantas Bt para prevenir plagas de lepidópteros principalmente. Aunque también hay proteínas Cry que afectan a otros insectos como dípteros o coleópteros. También hay que destacar, que ningún método es infalible, y los insectos también acaban desarrollando resistencias a la proteína Cry. Las plantas más conocidas son el algodón Bt y el maíz Bt (6).
El mecanismo de acción de la proteína Cry se explica aquí:
 |
| Fig. 5: Mecanismo de acción celular de Cry en coleópteros. La toxina Cry se une a BT-R y estimula la proteína G heterotrimérica y la Adenilato ciclasa (AC), lo que promueve la producción de AMPc intracelular. A su vez, la activación de Proteína kinasa A (PKA) desestabiliza el citoesqueleto y los canales iónicos causando la muerte de la célula. Esquema de Zhang en al. (2006). |
¿Como se hace esto?
Mediante técnicas de ingeniería genética, se puede modificar el plásmido Ti y dejar los mecanismos que nos interesa, eliminar la región oncogénica del T-DNA y sustituirla por un gen que queremos insertar en la célula vegetal. Las herramientas que se suelen emplear en este trabajo son las conocidas enzimas de restricción, unas proteínas que son capaces de cortar unas secuencias específicas en el genoma y se pegan los extremos utilizando otra enzima denominada polimerasa. Así conseguimos un plásmido que nos servirá de vector genético, para insertar un o varios genes en la planta. Si quiere saber un poco más vaya al apartado: Aclaraciones moleculares de la edición de secuencias de ADN.
¿Qué pasos se siguen?
Primero, este plásmido se introduce en el interior de Agrobacterium mediante diferentes técnicas y se seleccionan las cepas transformadas que tienen en el interior el plásmido que deseamos. Después, se enfrenta a la bacteria con la parte de la planta que queremos transformar. Hay que decir, que la bacteria solo transforma una serie de células que se exponen a la bacteria, por lo que si quieres tener generaciones de plantas que porten este nuevo gen hay que combinar varias técnicas.
El método que se suele emplear en plantas, es infectar una parte de la planta (parte de una hoja, tallo o raíz). Estas partes se infectan con Agrobacterium y después se cultivan in vitro. Esto es gracias a una propiedad que tienen las plantas y que no tiene ningún animal, que es la totipotencia. Cualquier célula vegetal puede desarrollar cualquier tejido de la planta y por ello se puede obtener una planta completa (7,8). Mediante diversos tratamientos con hormonas vegetales, se generan los diferentes tejidos. Se necesita conocer la combinación de hormonas para generar las diferentes partes de la planta, ya que no todas las plantas responden a los mismos estímulos hormonales. Este es el método de transformación que se representa en la figura 6.
Hay que decir, que aunque se use una bacteria que en la naturaleza genera tumores en la planta. Las cepas de Agrobacterium que se usan en ingeniería genética, en ningún caso generan tumores, porque esos genes tumorales han sido eliminados.
 |
| Fig.7: Formas de obtener una planta completa a partir de distintas partes de una planta. Fuente de imagen http://apuntesbiotecnologiageneral.blogspot.com |
Las células animales no son totipotentes salvo en los primeros estadios del desarrollo embrionario. Después, solo tenemos células pluripotentes que tienen capacidad de generar solo un número determinado de tejidos. Ya lo explicare en otras publicaciones.
Debo aclarar ante posibles dudas, que la tumoración que genera Agrobacterium es a causa de un desajuste en las hormonas vegetales auxinas y citoquinina (por si no ha quedado claro a lo largo de la explicación). Nosotros que pertenecemos al reino animal, no tenemos estas hormonas, ni la ingestión de estas hormonas nos afecta, ya que nuestras células no tienen receptores para estas hormonas. Esto es una tecnología moderna, que nos ayuda a solucionar graves problemas en la agricultura, generando plantas más resistentes a sequías, temperaturas extremas, plagas como las plantas Bt o resolver deficiencias nutricionales en los humanos como el Arroz dorado, al que se le introdujo el gen de la vitamina A para prevenir la ceguera en el tercer mundo.
Hay un miedo enorme a los transgénicos, asociado a que si consumimos estos alimentos, vamos a generar cáncer u otras enfermedades. Este miedo es una de esos rumores conspiratorios sin fundamento, que utilizan medias verdades para generar miedo en la población. Sin duda, es una tecnología que hay que tratar con precaución porque puede generar problemas ecológicos y que trataré en publicaciones posteriores. Pero, adelanto al público, que los alimentos que se comercializan como transgénicos, han sido evaluados por multitud de pruebas a través de la EFSA y son completamente SEGUROS.
Agrobacterium no es capaz de infectar todo tipo de plantas, por ello, existen otros mecanismos de transgénesis que iré explicando en futuras publicaciones.
Aclaraciones moleculares de la edición de secuencias de ADN (9).
Las enzimas de restricción o endonucleasa, son proteínas descubiertas en las bacterias como mecanismo de defensa a la inserción de ADN externo, generalmente por virus. Hay que entender, que estas enzimas no discrimina entre propio o lo ajeno, solo reconocen secuencias en el ADN y cortan. Algunos pensarían que la bacteria evita tener la secuencia que reconoce la enzima y así previene la autodegradación. Pero eso, es muy complicado, ya que las enzimas de restricción reconocen secuencias cortas de 4 y 6 aminoácidos generalmente. Además suelen reconocer secuencias palindrómicas, es decir que se leen igual a derecha, que ha izquierda, tal y como se muestra en el siguiente ejemplo:La enzima de restricción EcoRI (obtenida de Escherichia coli) reconoce la secuencia naranja
5´-ACCGTTGAATTCTAGCTGATCGA-3´
3´-TGGCAACTTAAGATCGACTAGCT-5´
Resultado de la reacción produce el siguiente corte:
5´-ACCGTTG-3´ 5´-AATTCTAGCTGATCGA-3´
3´-TGGCAACTTAA -5´ 3´-GATCGACTAGCT-5´
Se une un ADN con una secuencia complementaria al corte y la enzima polimerasa une los extremos 3´y 5´:
5´-ACCGTTGAATTAGGTTAAACCGACGACG-3´
3´-TGGCAACTTAATCCAATTTGGCTGCTGC-5´
3´-TGGCAACTTAATCCAATTTGGCTGCTGC-5´
Como se puede comprobar, no tienen porque haber sido cortados los extremos que se pega no con la misma enzima de restricción, porque encontrar la secuencia a veces es complicado y hay que diseñar estrategias para pegar lo que se quiere. En este caso al unir los ADN viejo y nuevo perdemos la diana de la enzima de restricción.
¿Pero como evita la célula bacteriana no degradar su ADN? Lo que hace es modificar uno o varios de sus aminoácidos en esa secuencia palindrómica, se le añade una metilación a esta secuencia mediante la enzima metilasa. Así, la enzima de restricción, no puede cortar la secuencia de ADN al no reconocerla como diana. El problema es que los virus que afectan a un tipo de bacteria, en este caso a Escherichia coli, también tienen el mismo patrón de metilación en su secuencia de ADN vírico (9).
Espero que esta publicación ayude a perder el miedo a los transgénicos y me animaré a escribir más sobre este campo.
#PMBAgrobacterium
Bibliografía:
- Hwang, H. H., Gelvin, S. B., & Lai, E. M. (2015). Editorial: "Agrobacterium biology and its application to transgenic plant production". Frontiers in plant science, 6, 265. doi:10.3389/fpls.2015.00265.URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4406079/
- Valentine, L. (2003). Agrobacterium tumefaciens and the plant: the David and Goliath of modern genetics. Plant physiology, 133(3), 948-55. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1540339/pdf/hw0948.pdf
- Gordon, J. E., & Christie, P. J. (2014). The Agrobacterium Ti Plasmids. Microbiology spectrum, 2(6), 10.1128/microbiolspec.PLAS-0010-2013.. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4292801/
- Pitzschke, A. (2013). Agrobacterium infection and plant defense-transformation success hangs by a thread. Frontiers in plant science, 4, 519. doi:10.3389/fpls.2013.00519.URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3866890/
- Gordon, J. E., & Christie, P. J. (2014). The Agrobacterium Ti Plasmids. Microbiology spectrum, 2(6), 10.1128/microbiolspec.PLAS-0010-2013. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4292801/
- SAUKA, DIEGO H., BENINTENDE, GRACIELA B. (2008), Bacillus thuringiensis: generalidades. Un acercamiento a su empleo en el biocontrol de insectos lepidópteros que son plagas agrícolas. Revista Argentina de Microbiología [en linea], 40 : [Fecha de consulta: 7 de noviembre de 2018] Disponible en:<http://www.redalyc.org/articulo.oa?id=213016787013> ISSN 0325-7541 . URL: http://www.scielo.org.ar/pdf/ram/v40n2/v40n2a13.pdf.
- Xu, X. Li, B. (1994). Fertile transgenic Indica rice plants obtained by electroporation of the seed embryo cells. Plant cell Rep. 13(3-4):237-42. doi: 10.1007/BF00239900. URL: https://www.ncbi.nlm.nih.gov/pubmed/24193659
- Altpeter, F., Springer, N. M., Bartley, L. E., Blechl, A. E., Brutnell, T. P., Citovsky, V., Conrad, L. J., Gelvin, S. B., Jackson, D. P., Kausch, A. P., Lemaux, P. G., Medford, J. I., Orozco-Cárdenas, M. L., Tricoli, D. M., Van Eck, J., Voytas, D. F., Walbot, V., Wang, K., Zhang, Z. J., … Stewart, C. N. (2016). Advancing Crop Transformation in the Era of Genome Editing. The Plant cell, 28(7), 1510-20. URL: http://www.plantcell.org/content/28/7/1510#sec-3.
- Perera, J. Tormo, J. García, J.L. (2002). Ingeniería genética, Volumen 1. España. Síntesis.
Sígueme en Twitter en @ParaMicroBio, puedes comentar esta publicación a través tiwtter con el hashtag #PMBAgrobacterium o en el blog, a través del formulario justo debajo de la publicación. Se admiten comentarios críticos, pero siempre desde el respeto, tampoco se permite spam. Los que no cumplan este requisito mínimo no se emiten. Tampoco nos hacemos responsables de la veracidad de los comentarios o las críticas.







Muy chulo! muy interesante, me ha servido para hacer un trabajo de la carrera jeje, muchas gracias :)
ResponderEliminarMuchas gracias, me alegro que le haya sido de utilidad.
EliminarMe ha gustado mucho! Lo he usado para hacer un trabajo de la uni :). Muchas gracias <3
ResponderEliminarEstimado Guillén, me alegro que le guste y sea de utilidad. Puede contactar para lo que necesite. Un saludo.
Eliminar